
Por primera vez, un equipo internacional de científicos logró revertir el daño neurológico asociado al Alzheimer en ratones y restaurar completamente la función cognitiva al restablecer el equilibrio energético cerebral.
El estudio, publicado en Cell Reports Medicine, fue liderado por investigadores del Centro Médico de los Hospitales Universitarios de Cleveland y la Universidad Case Western Reserve, en Estados Unidos, desafía más de un siglo de creencias sobre el avance irreversible del Alzheimer.
“Nuestro estudio demuestra que la enfermedad de Alzheimer se puede revertir en modelos animales para lograr una recuperación neurológica completa, no solo prevenirla o ralentizarla”, afirmó el psiquiatra Andrew Pieper, autor principal del estudio y director del Centro para la Salud Cerebral del Instituto Harrington de los Hospitales Universitarios de Cleveland.
La enfermedad de Alzheimer es la causa más frecuente de demencia, y representa entre el 60% y 80% de los casos a nivel global, según la Asociación Internacional de Alzheimer. Es una afección neurodegenerativa progresiva que afecta la memoria, el pensamiento y el comportamiento, y cuyos síntomas avanzan hasta interferir de forma severa con la vida diaria. Aunque la mayor parte de los diagnósticos ocurre en personas mayores de 65 años, existen formas de aparición más temprana.
El Alzheimer no forma parte del envejecimiento normal: es una enfermedad con un impacto devastador tanto en quienes la padecen como en sus familias, y actualmente no existe cura. Los tratamientos disponibles solo logran ralentizar el deterioro y mejorar temporalmente la calidad de vida.
“Este hallazgo es un mensaje de esperanza: los efectos de la enfermedad de Alzheimer podrían no ser inevitablemente permanentes. El cerebro dañado puede, en ciertas circunstancias, repararse y recuperar su función”, afirmó Pieper.
Cómo se hizo el estudio sobre Alzheimer en ratones

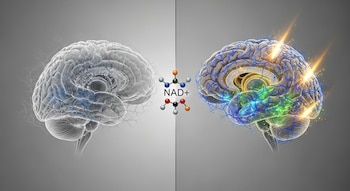
La investigación utilizó un compuesto farmacológico capaz de restablecer los niveles adecuados de NAD+ (nicotinamida adenina dinucleótido), una molécula esencial para la energía celular cerebral.
“Utilizando diferentes modelos de ratones con Alzheimer y análisis de cerebros humanos con la enfermedad, demostramos que la incapacidad del cerebro para mantener niveles normales de NAD+ es un factor importante del Alzheimer”, explicó Kalyani Chaubey, líder del equipo desde el laboratorio Pieper. Durante más de 100 años, la comunidad científica consideró que el Alzheimer solo podía prevenirse o ralentizarse, descartando la recuperación de las funciones perdidas, enfatizaron los autores del estudio.
“En consecuencia, la investigación se ha centrado en prevenir o ralentizar la enfermedad, en lugar de revertirla”, señaló Pieper, por eso consideró que nunca se realizó un ensayo clínico con el objetivo de revertir la enfermedad y recuperar capacidades deterioradas. El equipo de Cleveland desafió este principio, enfocándose en cerebros de ratones gravemente afectados.
Si bien el Alzheimer es una afección exclusivamente humana, se puede estudiar en el laboratorio con ratones modificados genéticamente para expresar mutaciones genéticas que causan Alzheimer en personas.
El estudio empleó dos modelos animales distintos de Alzheimer: un grupo de ratones con mutaciones en la proteína amiloide y otro con mutación en la proteína tau.
Ambas anomalías son características fundamentales del proceso patológico humano y los ratones presentaban deterioro de la barrera hematoencefálica, degeneración axonal, inflamación cerebral, déficit de neurogénesis en el hipocampo y daño oxidativo, junto a un marcado declive cognitivo.
“Demostramos en modelos animales no solo que preservar el equilibrio normal de NAD+ en el cerebro bloquea la aparición del Alzheimer, sino también que restaurar ese equilibrio en etapas avanzadas permite revertir la patología y recuperar la función cognitiva normal”, subrayó Chaubey.
Desde las primeras fases, los científicos detectaron que el NAD+ disminuye con la edad, pero esta caída resulta mucho más pronunciada en los cerebros con Alzheimer. “Sin un equilibrio adecuado de NAD+, las células acaban por perder la capacidad de ejecutar procesos críticos necesarios para su correcto funcionamiento y supervivencia”, explicó Chaubey. En el experimento, los investigadores restauraron el equilibrio de NAD+ administrando el compuesto P7C3-A20, desarrollado en el laboratorio Pieper.
El resultado fue notable: los ratones evitaron el desarrollo de la enfermedad y, aun en fases avanzadas, recuperaron la funcionalidad al recibir el tratamiento. Ambos modelos repararon los daños y recobraron completamente la función cognitiva.
“Restaurar el equilibrio energético cerebral logró una recuperación patológica y funcional en ambas líneas de ratones con Alzheimer avanzado. Observar este efecto en dos modelos animales muy diferentes, cada uno impulsado por causas genéticas distintas, refuerza la idea de que restaurar el equilibrio de NAD+ en el cerebro podría ayudar a los pacientes a recuperarse del Alzheimer”, enfatizó Pieper.
La recuperación cognitiva se validó con la medición de un biomarcador sanguíneo: la proteína tau 217 fosforilada. Tras el tratamiento, los valores de este biomarcador se normalizaron, lo que sugiere una reversión verificable de la enfermedad y respalda el uso de este marcador en futuros ensayos clínicos.
Las limitaciones del estudio y las perspectivas a futuro
Pese a lo prometedor del hallazgo, existen advertencias importantes: “Se ha demostrado en modelos animales que los precursores de NAD+ disponibles sin receta elevan el NAD+ celular a niveles peligrosamente altos que promueven el cáncer. Sin embargo, nuestro enfoque utilizó un agente farmacológico que permite a las células mantener su equilibrio adecuado de NAD+ en condiciones de estrés, sin elevar el NAD+ a niveles suprafisiológicos”, advirtió Pieper.
“A través de nuestro estudio demostramos una forma farmacológica de lograr esto en modelos animales, y también identificamos proteínas candidatas en el cerebro humano que podrían estar relacionadas con la capacidad de revertir la enfermedad”, explicó Chaubey.
“Este nuevo enfoque terapéutico debe implementarse en ensayos clínicos en humanos cuidadosamente diseñados para determinar si la eficacia observada en animales puede trasladarse a humanos”, concluyó Pieper. Las siguientes etapas comprenden la validación de mecanismos complementarios y la evaluación del alcance de este enfoque en otras enfermedades neurodegenerativas vinculadas al envejecimiento.
Últimas Noticias
Dormir menos de seis horas aumenta el riesgo de demencia y acelera el envejecimiento cerebral
La pérdida crónica de sueño en la mediana edad afecta la “red de limpieza” del cerebro e impacta en la salud de este órgano. Cuáles son las medidas preventivas para descansar mejor, según la ciencia

La obesidad incrementa hasta un 70% el riesgo de fallecer por infecciones
Una investigación observacional advierte que quienes presentan dicho problema enfrentan un riesgo notablemente superior de hospitalización o fallecimiento por enfermedades infecciosas
Grasas saturadas y riesgo cardiovascular: qué recomiendan los expertos para proteger el corazón
La evidencia científica citada por Verywell Health destaca que el efecto según el patrón alimentario general y los factores de riesgo individuales, guiando nuevas recomendaciones nutricionales

El estudio británico que rompe mitos sobre adolescentes y redes sociales: ¿realmente afectan la salud mental?
Investigaciones de la Universidad de Edimburgo cuestionan la relación directa entre conexión digital y bienestar emocional en jóvenes, e invitan a revisar los enfoques actuales sobre el impacto de las pantallas

Cuáles son las claves para reconocer el lenguaje no verbal
Gestos, posturas y miradas pueden mostrar inseguridad, dudas o motivaciones que las palabras no revelan




