La Administración de Alimentos y Medicamentos (FDA) de Estados Unidos confirmó una alerta sanitaria y ordenó el retiro inmediato de más de 11.000 frascos del medicamento antihipertensivo Ziac, tras detectarse la presencia de un segundo fármaco en su composición.
Aunque este producto también se comercializa en Perú, las autoridades han precisado que los lotes retirados corresponden exclusivamente al mercado estadounidense, por lo que no afecta a esta parte de Sudamérica.
De acuerdo a expertos, el reciente episodio pone bajo vigilancia a las entidades regulatorias peruanas, mientras se mantiene al alcance del público local este medicamento con receta en conocidas cadenas de farmacias.

La Administración de Alimentos y Medicamentos (FDA) de Estados Unidos informó que el retiro de Ziac obedece a la detección de trazas de ezetimiba, un compuesto utilizado contra el colesterol, en frascos del antihipertensivo.
El laboratorio fabricante, Glenmark Pharmaceuticals, tomó la decisión de retirar del mercado más de 11.100 frascos luego de que pruebas internas confirmaran la presencia inesperada de este ingrediente, también fabricado por la misma empresa.
Según precisó Clarín, las presentaciones afectadas corresponden a envases de 30, 100 y 500 unidades, identificadas con los códigos NDC 68462-878-30, NDC 68462-878-01 y NDC 68462-878-05, con fechas de vencimiento desde noviembre de 2025 hasta mayo de 2026.

La FDA catalogó este caso como un “Retiro de Clase III”, un término técnico que indica un bajo riesgo de consecuencias adversas para la salud. Al respecto, funcionarios federales consultados por Clarín remarcaron que “no es probable que el uso o la exposición al producto cause consecuencias adversas para la salud”.
Qué implica el retiro Clase III
De acuerdo con el marco regulatorio estadounidense, un Retiro de Clase III se emite cuando la exposición a un producto farmacéutico “no debería causar efectos perjudiciales”.
Existen tres niveles de riesgo: Clase I y II, que involucran riesgos mayores, y Clase III, donde la urgencia es menor. La FDA sostiene que los retiros pueden iniciar a solicitud de la empresa, del organismo regulador o mediante una orden legal. En este caso, Glenmark Pharmaceuticals procedió de manera voluntaria, aplicando los protocolos oficiales y comunicando la medida rápidamente a los distribuidores y farmacias.

La agencia federal estadounidense recomendó a los usuarios acudir a su médico o farmacéutico en caso de poseer medicamentos incluidos en la alerta. Además, la publicación norteamericana The Hill reportó que la presencia de ezetimiba fue detectada gracias a análisis internos del laboratorio, lo que aceleró la remoción de las presentaciones afectadas.
Venta de Ziac en Perú
En el contexto peruano, Ziac 5,0 mg se ofrece actualmente en la web de Inkafarma con prescripción médica y un precio regular de 155 soles por caja de 30 tabletas recubiertas.
Hasta el momento, ni Inkafarma ni las autoridades sanitarias locales han reportado incidentes ni lotes afectados en el país. Se mantiene la advertencia de que la alerta corresponde exclusivamente al territorio estadounidense.
Las autoridades sanitarias de Perú se encuentran alerta ante información internacional de este tipo, aunque el retiro oficial involucra solo productos comercializados en Estados Unidos. El reporte subraya la necesidad de un monitoreo permanente por parte del sector Salud para detectar cualquier potencial riesgo en productos importados o distribuidos en farmacias nacionales.
Reacciones y protocolos
En el ámbito internacional, se destacó que la ezetimiba hallada no representa, según la FDA, un riesgo sanitario alto para quienes utilizan el antihipertensivo Ziac. Los expertos reconocen que aunque el contacto con cantidades mínimas de este segundo principio activo es improbable que genere efectos adversos, pero la medida preventiva busca mantener los mayores estándares de calidad y seguridad exigidos en Estados Unidos.
El procedimiento de retiro voluntario implementado por Glenmark Pharmaceuticals constituye una respuesta habitual dentro del sistema estadounidense, donde la detección automática de cualquier irregularidad desencadena reportes inmediatos y medidas correctivas.
Supervisión sanitaria
La experiencia estadounidense con el retiro de lote activa las alertas preventivas en los sistemas regulatorios latinoamericanos, si bien no se han reportado casos ni advertencias locales asociadas a contaminación con ezetimiba. Especialistas sostienen que es fundamental la vigilancia constante sobre productos importados y la cooperación internacional para la identificación de riesgos potenciales en el mercado farmacéutico.
“La alerta fue publicada tras comprobarse la presencia inesperada de ezetimiba durante pruebas de calidad efectuadas por el propio fabricante”, según recoge Clarín en su cobertura sobre el episodio.
Más Noticias
¡Reventó La Tinka! Sorteo del domingo 25 de enero entregó más de S/ 19 millones
El pozo millonario cayó tras semanas de acumulación. Revisa aquí la jugada ganadora

Qué se celebra el 26 de enero en el Perú: memoria, conflicto y consolidación institucional a través de los siglos
La conmemoración de esta fecha revela hitos que marcaron el rumbo del país, desde autonomías fundacionales y tragedias en el periodismo hasta crisis políticas y transformaciones en la defensa nacional

Congresista Kira Alcarraz vuelve a ser intervenida por la PNP y su conductor queda detenido tras dosaje etílico positivo
La parlamentaria se resistió a una intervención vehicular, discutió con los efectivos y realizó gestos obscenos, según informó el dominical Punto Final

Resultados del Gana Diario de este 25 de enero: todos los números ganadores del último sorteo
Como cada domingo, La Tinka comparte los números ganadores del sorteo millonario del Gana Diario. Estos son los resultados del sorteo 4472

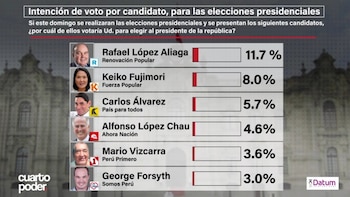
Elecciones 2026: estos son los candidatos presidenciales con mayor intención de voto, según Datum
El estudio nacional evidencia una fuerte desconfianza hacia la clase política y un mensaje claro contra candidatos vinculados a actividades ilícitas. Sondeo difundido revela que 25,9 % votaría en blanco o viciado y 65 % prefiere un outsider